Witam serdecznie wszystkich czytelników. Niniejszym postem otwieram bloga dotyczącego przede wszystkim pożarów wewnętrznych, ale też innych kwestii związanych z byciem strażakiem. Mam nadzieję, że moja działalność zostanie dobrze przyjęta przez czytelników i że przysłuży się rozwojowi zarówno jakości działań gaśniczych, jak też rozwojowi czegoś, co nazywam "wolną myślą ratowniczą". Zapraszam do lektury jak również kontaktu ze mną i wpisów na stronie!
***********************
Czemu może być poświęcony pierwszy tekst, jeśli nie "trójkątowi spalania"? Stanowi on podstawę zrozumienia wszelkich ważnych zjawisk, a jednocześnie wydaje się być tak prosty, że aż często bywa rozumiany zbyt powierzchownie. Przyjrzymy się zatem poszczególnym jego elementom, jak też postaramy się przeanalizować ich interakcje w pożarze wewnętrznym.
Jak widać na poniższym obrazku, w skład „trójkąta” wchodzą elementy takie, jak:
· paliwo – to każda substancja, mająca zdolność spalania się
· utleniacz – tlen z powietrza
· ciepło – odgrywające dwojaką rolę zainicjowania i podtrzymania procesu,
· wolne rodniki – powstające w wyniku reakcji chemicznych niesparowane (nieposiadające pary) wiązania międzycząsteczkowe, sprzyjające powstawaniu rozgałęzionej reakcji łańcuchowej rozkładu i utleniania (spalania).
Mówimy o trójkącie, jednak wymieniamy cztery elementy... Jakiś czas temu zwracano uwagę jedynie na 3 elementy procesu spalania, nie znając znaczenia obecności wolnych rodników. W momencie odkrycia chemicznej strony reakcji spalania i dodania do ww. listy czwartego elementu, pojawił się czworokąt spalania. Niekiedy też trójkąt rysowany jest tak, jak na poniższym rysunku (Rys. 1). W niektórych przypadkach, szczególnie w literaturze anglojęzycznej, pojawia się czworościan (tetrahedron). Jest to bryła, która powstałaby, gdyby w powyższym trójkącie środkowy element posłużył za podstawę, a kąty trójkąta zostały połączone w jednym punkcie (Rys. 2). Co ciekawe czworościan foremny został opisany przez swego odkrywcę, Platona, jako bryła opisująca ogień. W swoim dialogu Timajos grecki filozof napisał, że każdy żywioł można utożsamić z jedną z doskonałych (foremnych) brył, a czworościan jest właśnie symbolem ognia. Było to kilkaset lat p.n.e.!
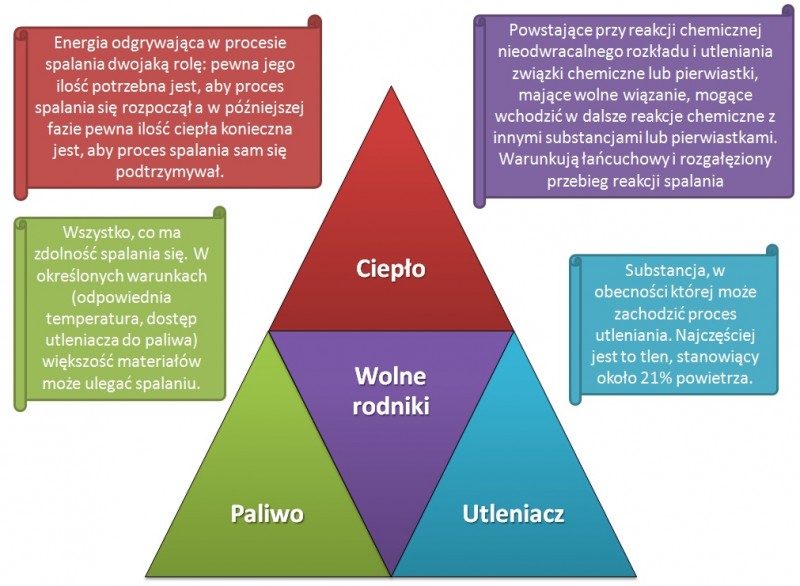
Rys. 1: Trójkąt spalania.
.jpg)
Rys. 2: Czworościan spalania.
Wracając do paliwa, można ogólnie powiedzieć, że paliwem jest wszystko, co nas otacza i ma zdolność spalania. Czasem nawet usłyszymy, że wszystko się pali, to jedynie kwestia temperatury. Jest to wprawdzie nie do końca prawdą, ale owszem większość materiałów spala się, jeśli osiągnie odpowiednią temperaturę. Ktoś kiedyś zapytał "A czy woda się pali?". Prosta odpowiedź może brzmieć "tak", chociaż nie oddaje to do końca sedna sprawy. Cząsteczka wody (H2O), jak wiemy, składa się z 2 atomów wodoru i jednego atomu tlenu. Tlen jest w naszym trójkącie utleniaczem, natomiast wodór jest gazem palnym, tworzącym atmosfery wybuchowe. Jednakże wiązania między atomami są bardzo silne i potrzeba dostarczenia dużej energii, aby owe wiązania zrywać. Dlatego w standardowej temperaturze pożaru (przyjmijmy 300-1000°C) woda nie będzie się spalać - będzie za to doskonale chłodzić (odbierać ciepło) i tym samym gasić pożar. Jeśli jednak dostarczymy dużą ilość energii to dojdzie do zerwania wiązań i powstania atomów wodoru i tlenu. Przykładowo, w przypadku pożarów metali (grupa pożaru D) występujące temperatury są bardzo wysokie (3000-5000°C). Dlatego takich pożarów nie gasi się wodą, bowiem wysoka energia towarzysząca reakcji spalania wystarcza do rozerwania wiązań i wytworzenia atmosfery wybuchowej poprzez rozdzielenie się tlenu i wodoru! W opisywanych warunkach powstaje wybuchowy wodór i tlenki metalu. Wracając jednak do kwestii wszechobecności paliwa – można swobodnie przyjąć, że niemal w każdym miejscu, związanym z bytowaniem człowieka, znajduje się materiał palny. Właściwości niektórych z tych materiałów czynią je bardziej niebezpiecznymi pożarowo od innych. Jedną z takich właściwości jest ciepło spalania. Jest to parametr, charakterystyczny dla danej substancji czy materiału, mówiący o tym ile ciepła wydzieli się z jednostki masy tego materiału przy całkowitym spaleniu. Jeśli porównamy dane z poniższej tabeli (tabela 1) to zobaczymy, że ta sama masa danego paliwa (1kg) wydzieli różną ilość ciepła [MJ] przy całkowitym spaleniu. Kolejnym wnioskiem może być taki, że paliwa pochodzenia organicznego zawierają w sobie mniej potencjalnej energii uwalnianej na drodze spalania, aniżeli materiały pochodzenia syntetycznego. Często różnica ta jest dwukrotna lub nawet większa!
|
Lp. |
Rodzaj materiału |
Qc – Ciepło spalania w MJ/kg |
|
1. |
Aceton |
31 |
|
2. |
Acetylen |
50 |
|
3. |
Aluminium (proszek, folie) |
31 |
|
4. |
Bawełna (zgremplowana i wyroby) |
17 |
|
5. |
Butan |
46 |
|
7. |
Drewno (zawartość wilgoci do 12 %) |
18 |
|
8. |
Drewno (zawartość wilgoci ponad 12 %) |
15 |
|
9. |
Gliceryna |
18 |
|
10. |
Heksan |
48 |
|
11. |
Izopren kauczukowy |
45 |
|
12. |
Jedwab naturalny (surowiec) |
21 |
|
13. |
Jedwab naturalny (wyroby) |
19 |
|
14. |
Jedwab sztuczny |
17 |
|
15. |
Kora dębowa |
17 |
|
16. |
Koks |
29 |
|
17. |
Len (surowiec i wyroby) |
15 |
|
18. |
Metan |
57 |
|
19. |
Naftalen |
40 |
|
20. |
Nitrobenzen |
25 |
|
21. |
Opony gumowe |
32 |
|
22. |
Papier |
16 |
|
23. |
Parafina |
62 |
|
24. |
Pentan |
49 |
|
25. |
Pianka poliuretanowa (PU) |
26 |
|
26. |
Płyta wiórowa |
18 |
|
27. |
Poliamidy (P A) |
29 |
|
28. |
Polichlorek – wyroby plastyfikowane (PCV) |
25 |
|
29. |
Polichlorek winylu |
21 |
|
30. |
Poliester |
31 |
|
31. |
Poliester, wzmacniany włóknem |
21 |
|
32. |
Poliwęglany (PC) |
29 |
|
33. |
Poliuretany (PU) |
25 |
|
34. |
Polistyren i wyroby (PS) |
42 |
|
35. |
Polipropylen (PP) |
43 |
|
36. |
Polietylen i wyroby (PE) |
42 |
|
37. |
Ropa naftowa |
41 |
|
38. |
Proch i bawełna strzelnicza |
5 |
|
39. |
Smoła |
35 |
|
40. |
Smary |
41 |
|
41. |
Stearyna |
39 |
|
42. |
Słoma (różnych zbóż i nasion oleistych) |
15 |
|
43. |
Siano |
15 |
|
44. |
Szmaty (średnio) |
19 |
|
45. |
Tekstylia |
19 |
|
46. |
Tlenek węgla |
10 |
|
47. |
Wełna (surowiec) |
23 |
|
48. |
Wełna oczyszczona i wyroby |
21 |
|
49. |
Węgiel brunatny |
22 |
|
50. |
Węgiel drzewny |
30 |
|
51. |
Węgiel kamienny (średnio) |
32 |
|
52. |
Wodór |
143 |
|
53. |
Wosk parafinowy |
47 |
|
54. |
Zboża (ziarno) – średnio |
16 |
Inną cechą przesądzającą o palności danego ciała jest inercja termalna (bezwładność cieplna). Właściwość ta decyduje o szybkości nagrzewania się danego ciała oraz o jego palności (bądź niepalności), inaczej mówiąc opisuje sposób reagowania ciała na zmiany temperatury. Inercja termalna jest ilorazem trzech właściwości danego ciała:
- przewodności termalnej (k),
- gęstości danego ciała (ρ) – grecka litera „ro”,
- pojemności cieplnej (c).
Z powyższych parametrów wypada zwrócić dodatkowo uwagę na pojemność cieplną. Ów parametr będzie jeszcze nam towarzyszył przy rozważaniach na inne tematy. Pojemność cieplna danego ciała mówi nam, ile ciepła może ono pochłonąć, aby ogrzać się (podnieść swoją temperaturę) o 1 stopień. Jeśli mówimy o pochłonięciu danej ilości ciepła (J) przez daną jednostkę masy ciała (kg) w celu podniesienia temperatury o jedną jednostkę (K), wówczas mamy do czynienia z tzw. ciepłem właściwym, zwanym inaczej „masową właściwą pojemnością cieplną” (J/kg∙K). Pojemność cieplna jest jednym z parametrów pozwalających określać skuteczność gaśniczą różnych środków gaśniczych, działających na zasadzie odbierania ciepła (gaszenie może odbywać się na wiele różnych sposobów – poprzez odebranie jednego lub kilku elementów czworokąta spalania).
W warunkach pożaru ciepło dostarczane jest do materiałów na drodze promieniowania. Dokładnie opiszemy to w dalszej części artykułu. Natomiast zależnie od wartości inercji termalnej danego ciała, dana ilość ciepła spowoduje nagrzanie powierzchni tego ciała do jakiejś konkretnej temperatury w danym czasie. Im wartość inercji większa, tym nagrzewanie trwa dłużej. W niektórych przypadkach inercja termalna ciała jest tak duża, że zapalenie ciała jest niemożliwe. W innych przypadkach, ta sama dawka promieniowania cieplnego zapali dane ciało już po krótkim czasie. Zatem, jak wspomniano wcześniej, zależnie od wartości inercji termalnej, różne ciała będą się różnie zachowywać w trakcie ekspozycji na promieniowanie cieplne. W tabeli poniżej można zapoznać się z przykładowymi ciałami i ich właściwościami wpływającymi na inercję.
|
Materiał |
K (W/mK) |
c (J/kg∙K) |
ρ (kg/m3) |
kρc (W2s/m4∙K2) |
|
Płyta wiórowa |
0.14 |
1,400 |
600 |
120,000 |
|
Płyta pilśniowa drewniana |
0.05 |
2,090 |
300 |
32,000 |
|
Poliuretan |
0.034 |
1,400 |
30 |
1,400 |
|
Stal |
45 |
460 |
7,820 |
160,000,000 |
|
Drewno sosnowe |
0.14 |
2,850 |
520 |
210,000 |
Kolejnym elementem naszego trójkąta spalania jest tlen. O ile jego wpływ na pożar jest oczywisty – wynika wprost z czworokąta spalania – o tyle można na jego temat powiedzieć nieco więcej i często nie jest to wiedza powszechna. Jak widać na rysunku 1 utleniaczem do reakcji spalania jest właśnie tlen. Pochodzić może on z powietrza, ale również może występować w składzie chemicznym materiału spalającego się. Przykładem materiału palnego zawierającego tlen jest drewno, zawierające około 40% tlenu w swoim składzie chemicznym.
Materiały palne zawierające tlen będą spalać się nieco inaczej, niż materiały pozbawione tlenu lub zawierające go niewielką ilość. Na charakterystykę palną materiałów wpłynie między innymi stopień wymieszania materiału palnego z powietrzem lub inaczej mówiąc stopień rozdrobnienia. Jeśli weźmiemy daną ilość materiału palnego – powiedzmy 10 kg drewna – w formie zwartej (belka) i spróbujemy podpalić zapalniczką, to nie uda nam się rozpocząć procesu spalania. Gdy tą samą ilość drewna pociąć na wykałaczki, zapalenie od względnie małego płomienia zapalniczki jest proste a spalanie rozwinie i rozprzestrzeni się na cały materiał palny bez większego problemu. Taka jest właśnie różnica wynikająca ze stopnia rozdrobnienia, czyli wymieszania z powietrzem. Idąc dalej tym tropem, drewno rozdrobnione do postaci pyłu będzie spalać sie najszybciej i najintensywniej – łącznie z możliwością powstania wybuchu. Stąd pył drzewny (jak również inne pyły, np. mąka, cukier-puder itp.) ma zdolność wybuchu. Pamiętając jednak o wymieszaniu z powietrzem trzeba dodać, że pył zalegający na podłożu w hałdzie będzie raczej leniwie się tlił, natomiast dopiero wzbity w powietrze stworzy chmurę wybuchową! Na koniec wypada dodać jeszcze jedną rzecz – 10 kg drewna w formie wykałaczek spali się szybciej, a belka o tej masie wymagać będzie dłuższego dostarczania tej energii w celu ogrzania do pewnej temperatury, ale również dłużej potrwa usunięcie tego ciepła z materiału (schłodzenie). Bez takiej ekstrakcji ciepła z materiału palnego ciężko jest cokolwiek trwale ugasić a nagrzany materiał jest oczywiście bardziej podatny na nawrót spalania.
Skoro niektóre materiały palne zawierają tlen w swoim składzie chemicznym, to będą spalać się łatwiej, aniżeli niektóre inne materiały. Wśród opisów procesu spalania możemy napotkać kilka stwierdzeń:
- spalanie całkowite – to proces spalenia, w którym spaleniu ulega cała masa substancji,
- spalanie zupełne – produktami takiej reakcji są najtrwalsze możliwe do uzyskania produkty.
O tym, czy spalanie będzie zarówno zupełne jak i całkowite decyduje m.in. współczynnik nadmiaru powietrza. Pamiętajmy, że w przypadku węglowodorów spalanie przebiega zgodnie ze schematem:
C2H4 + 3O2 → 2CO2 + 2H2O
Wypada dodać, że z chemicznego punktu widzenia ów proces przebiega przez wiele etapów pośrednich i towarzyszy mu zazwyczaj od kilkunastu do nawet kilkuset reakcji pośrednich (zazwyczaj jest to kilkadziesiąt reakcji) zanim otrzymane zostaną produkty końcowe reakcji. Dodając do tego obecność innych pierwiastków (przykładowo duże ilości azotu N – około 4/5 składu powietrza) oraz turbulentny przebieg tego procesu, można śmiało powiedzieć, że powyższa reakcja zajdzie jedynie w kontrolowanych i zaplanowanych warunkach laboratoryjnych, a w warunkach spalania nazwijmy je spontanicznego kwestia przebiegu reakcji i powstających produktów jest bardzo płynna! W literaturze branżowej można spotkać przykłady przebiegu całej reakcji spalania prostych związków. Weźmy przykład utleniania metanu (CH4) w tlenie – kompletna reakcja przebiega przez 123 reakcje pośrednie! Są to reakcje zachodzące bardzo szybko a spalenie małej ilości wspomnianej substancji trwa dosłownie krótką chwilę.
Omawiając dostępność tlenu wypada zwrócić uwagę czytelnika na dodatkowe informacje. Podstawowa informacja jest taka, że tlen stanowi około 21% składu chemicznego powietrza. W przypadku atmosfery wzbogaconej w tlen (zawartość powyżej 21%) spalanie będzie przybierać charakter o wiele bardziej dynamiczny. Im wyższe stężenie tlenu, tym bardziej intensywne spalanie. W przypadku atmosfery bardzo bogatej w tlen (rzędu około 31%) nawet niepalny materiał, jakim jest Nomex (R) zacznie się intensywnie spalać. Jednak w pożarze mamy częściej do czynienia ze spadkiem stężenia tlenu poniżej wartości właściwej dla powietrza atmosferycznego. Zależnie od spalanego materiału spadek stężenia tlenu poniżej pewnej wartości powoduje brak możliwości spalania.
Wróćmy do prześledzonej przed chwilą reakcji. Widzimy, że węglowodór spalany w tlenie daje trwałe (ostateczne) produkty w postaci dwutlenku węgla (gaz niepalny, używany też jako środek gaśniczy) i wody (w formie pary wodnej). Mamy zatem do czynienia z reakcją całkowitą (spaleniu uległa cała masa substancji) oraz zupełną (produkty reakcji są trwałe – w warunkach spalania nie powstanie z nich nic innego). Dla przykładu, gdyby zabrakło cząstek tlenu, to po stronie produktów otrzymalibyśmy cząstki tlenku węgla (CO). W związku z tym mielibyśmy do czynienia z reakcją niezupełną, bowiem CO może dalej utleniać się do CO2. Jak już podkreślano, w praktyce spalanie całkowite i zupełne możliwe jest jedynie w ściśle kontrolowanych warunkach laboratoryjnych. W warunkach zapalenia materiału palnego, przechodzącego później w pożar, zawsze występuje niedobór tlenu do spalania wszystkich cząsteczek paliwa, dlatego po stronie produktów spalania znajdziemy całą gamę różnorakich substancji. Ich skład chemiczny zależeć będzie od składu chemicznego i właściwości fizykochemicznych spalającego się paliwa, etapu procesu spalania, dopływu powietrza, temperatury procesu spalania, wilgotności powietrza itd. Produkty będą zatem substancjami składającymi się w różnych kombinacjach z cząstek węgla (C), wodoru (H), tlenu (O), azotu z powietrza (N) i innych pierwiastków znajdujących się w paliwach (np. siarki S czy chloru Cl). Najbardziej powszechnymi są wszelkiego rodzaju węglowodory, które w głównej mierze przekładają się na palność dymu pożarowego.
Jak widać z dotychczasowych rozważań, nie sposób omawiać elementów czworokąta spalania oddzielnie, chcąc poruszyć owe zagadnienia na poziomie nieco głębszym od podstawowego. Stąd płynnie przeszliśmy do utleniacza. Jak wspomniano, najczęściej będzie to tlen z powietrza, ewentualnie tlen zawarty w składzie chemicznym danego paliwa. Chyba większość czytelników wie, że dodawanie tlenu do ogniska pożaru sprzyja rozwojowi procesu a jego odbieranie ten proces spowalnia i osłabia jego dynamikę. Jednak związek tlenu z procesem spalania jest jeszcze bardziej ścisły. Już od niemal 100 lat, bowiem od roku 1917 wiadomo, że ilość tlenu jest wprost proporcjonalna do ilości ciepła wydzielanego w pożarze. We wspomnianym roku, brytyjski uczony William M. Thornton, w swoim artykule dotyczącym wpływu tlenu na ciepło spalania materiałów organicznych wyjaśnił, że energia cieplna wyzwalana ze spalania węglowodorów zależy od ilości tlenu dostępnego w procesie spalania i że niezależnie od rodzaju węglowodoru, dana ilość tlenu pozwala na wydzielenie się pewnej, stałej ilości ciepła. Ową tezę zbadano jeszcze w latach 70-tych w NIST (National Institute of Standards ad technology – Krajowy Instytut Standardów i Technologii) i potwierdzono wyniki badań Thorntona. Niejaki C. Huggett zweryfikował wyniki pracy Thorntona, wykorzystując technikę pomiaru ciepła spalania opracowaną w NIST. W swojej pracy Hugget był w stanie dokonać pomiarów ilości wydzielającego się ciepła w celu potwierdzenia wcześniejszych ustaleń Thorntona, stąd dziś reguła ta nadal nazywana jest regułą Thorntona.
W wyniku przeprowadzonych pomiarów ustalono, że:
- metan (główny składnik gazu ziemnego) charakteryzuje się ciepłem spalania 12,54 kJ dla każdego grama tlenu (12,54 kJ/gO2),
- średnia dla wszystkich gazów węglowodorowych wynosi 12,72 kJ/gO2,
- dla drewna klonowego wartość ta wynosi 12,51 kJ/gO2,
- dla wełny wartość ta wynosi 13,61 kJ/gO2,
- średnia wartość ilości wydzielanego ciepła podczas procesu spalania dla materiałów pochodzenia naturalnego (wybrane przykłady przedstawiono powyżej) wynosi 13,21 kJ/gO2,
Dla porównania z najczęściej spotykanymi tworzywami sztucznymi o budowie polimerowej:
- polietylen charakteryzuje się wartością 12,65 kJ/gO2,
- nylon-6,6 wydziela 13,23 kJ/gO2,
- średnia wartość dla najczęściej stosowanych polimerów syntetycznych wynosi 13,02 kJ/gO2.
Widzimy zatem, że większość paliw spala się wydzielając podobną ilość ciepła przy dostarczeniu stałej ilości tlenu. Ale jak zauważono wcześniej niektóre paliwa mają wyższą wartość ciepła spalania. Inaczej mówiąc potencjalnie zawierają więcej energii cieplnej możliwej do uwolnienia w procesie spalania. Czy zatem spalanie z ich udziałem będzie charakteryzować się wyższą temperaturą? Niekoniecznie. Przede wszystkim temperatura i ciepło to nie to samo – o tym za chwilę. Natomiast to szybkość dostarczania tlenu do strefy spalania i jego ogólna ilość zdecydują o dynamice tego procesu spalania. Zakładając, że opisane wcześniej warunki dotyczące paliwa (rozdrobnienie, wzajemne ułożenie itd.) są sprzyjające i spalanie będzie się rozwijać w pożar, możemy wyróżnić dwa charakterystyczne stany, w jakich może znaleźć się pożar. Na początku procesu spalania o charakterze pożaru (tzn. spalanie w przypadku braku reakcji przerodzi się w pożar) możemy mówić o „pożarze kontrolowanym przez paliwo” (KPP), co oznacza, że na dynamikę spalania wpływa jedynie charakterystyka paliwa (ilość, palność, stopień rozdrobnienia, wzajemne ułożenie, ciepło spalania) a nie dostęp powietrza. W miarę powiększania się strefy spalania, ilość dopływającego powietrza zaczyna być niewystarczająca do utrzymania wciąż rosnącej dynamiki rozwoju pożaru i wydzielania wciąż rosnących ilości ciepła. W pewnym momencie dochodzi do stanu, w którym dynamika rozwoju zaczyna być kierowana całkowicie przez ilość dopływającego powietrza. Mówimy wówczas o „pożarze kontrolowanym przez wentylację” (KPW). Występujący w tym okresie niedobór tlenu spowodowany jest właśnie dużym zapotrzebowaniem na ten element trójkąta spalania, co wynika z wydzielania dużych ilości ciepła, zbliżając pożar do momentu wystąpienia zjawiska rozgorzenia. Dzieje się to przy intensywnym odpływie gazów pożarowych od strefy spalania, stąd burzliwy przebieg wymiany gazowej i widoczne turbulencje płaszczyzny neutralnej, będącej poziomą granica między strefą zadymienia a strefą wolną od dymu. Ta cecha charakterystyczna zachowania się dymu (płaszczyzny neutralnej) może posłużyć, jako jedna z oznak pożaru, służąca do rozpoznania warunków pożarowych i fazy pożaru. Pojawienie się turbulencji w obszarze płaszczyzny neutralnej zwiastuje moment zmiany charakteru procesu spalania i na ogół (choć nie zawsze) zapowiada zbliżający się moment wystąpienia zjawiska rozgorzenia. Z jednej strony przyrastająca strefa zadymienia napiera w dół w wyniku ciągłej produkcji dymu i jego termicznej ekspansji (zwiększania objętości w wyniku wzrostu temperatury) a z drugiej strony powietrze napływa z większą dynamiką dyktowaną rosnącym zapotrzebowaniem na tlen w strefie spalania. Te dwa przeciwstawne przepływy gazów prowadzą swego rodzaju walkę o przestrzeń, bowiem fakt istnienia procesu spalania w głębi pomieszczenia oddziałuje intensywnie tak na jeden jak i drugi przepływ. W tym momencie wróćmy na chwilę do ciepła spalania. Skoro jedne materiały wydzielają go więcej od innych to albo wydzielą to ciepło szybciej albo spalanie będzie trwać dłużej – a wszystkim kierować będzie dostęp tlenu (mówiąc ogólnie powietrza). Skoro mowa o pożarze wewnętrznym to proces spalania umiejscowiony jest w pewnej kubaturze zamkniętej z istniejącymi otworami (drzwi, okna, szyby wentylacyjne itd.), które są drożne (otwarte) lub też nie (zamknięte). Oznacza to, że w praktyce łączna powierzchnia otworów doprowadzających tlen do pomieszczeń będzie miała bezpośredni wpływ na dynamikę rozwoju pożaru. Patrząc na to z jeszcze innej strony – pożary z udziałem materiałów syntetycznych będą szybciej zużywać dostępny tlen i będą charakteryzować się większym zapotrzebowaniem na tlen, dlatego szybciej będą przechodzić w stan pożaru kontrolowanego przez wentylację. I tu kolejna uwaga – obecnie każdy pożar to zjawisko przebiegające z udziałem materiałów syntetycznych. Odmiennie sytuacja wyglądała około 50 lat temu, kiedy większość wyposażenia stanowiły materiały naturalne (drewno, bawełna) lub nieznacznie przetworzone. Dziś wiele z materiałów to pochodne ropy naftowej, nazywane zresztą przez niektórych strażaków „benzyną w formie ciała stałego”. Dzisiejszy pożar – w odróżnieniu od pożaru naszego dziadka – przebiegał będzie bardziej intensywnie i szybciej przechodził w stan pożaru kontrolowanego przez wentylację, większy będzie też wpływ wszelkich zmian dokonywanych w tzw. profilu wentylacji (otwieranie drzwi, wybijanie lub wypadanie okien). W połączeniu z istniejąca w budownictwie tendencją do „otwierania przestrzeni”, czyli łączenia pomieszczeń, likwidowania ścian działowych itd., zmniejsza się szansa na to, że pożar zostanie ograniczony do jednego pomieszczenia i ulegnie znacznemu stłumieniu właśnie w wyniku braku tlenu. Wypada w tym miejscu dodać, że istnieje tez skrajny stan pożaru kontrolowanego przez wentylację, zwany „pożarem niedowietrzonym” lub niedotlenionym. Ów stan sprzyja występowaniu zjawiska „backdraftu”, czyli „wstecznego ciągu płomienia” i zostanie opisany w kolejnych artykułach na cfbt.pl.
Wspomniane badania prowadzone w NIST w latach 70tych doprowadziły do stworzenia krzywej pożaru wewnętrznego, która jest powszechnie znana wszystkim osobom zainteresowanym tą tematyką. Jednak mając na uwadze wspomnianą prędkość zużywania tlenu w pożarze, jak też wpływ zmian w profilu wentylacji, wydaje się, że owa krzywa jest już nieco przestarzała. Ową hipotezę potwierdziły kolejne badania nad zjawiskiem pożaru wewnętrznego, które były prowadzone na przestrzeni ostatnich lat w Instytucie Badań nad Bezpieczeństwem Strażaków firmy Underwriters Laboratories (UL Firefighter Safety Research Institute).
UL (Underwriters Laboratories) jest firmą doradczą i certyfikującą w dziedzinie bezpieczeństwa z siedzibą w Northbrook, Illinois. Utrzymuje biura w 46 krajach, w tym w Polsce. UL została założona w 1894 roku i brała udział w analizie bezpieczeństwa wielu nowych technologii minionego stulecia, w szczególności powszechnego przyjęcia do użytku energii elektrycznej i opracowywaniu norm bezpieczeństwa dla urządzeń elektrycznych i komponentów. UL zapewnia w zakresie bezpieczeństwa certyfikaty, sprawdzanie, testowanie, kontrolę, audyt, doradztwo i usługi szkoleniowe dla szerokiej gamy klientów, w tym producentów, detalistów, strategów działalności, organów regulacyjnych, firm usługowych, jak i konsumentów indywidualnych. UL to jedna z kilku firm zatwierdzonych do wykonywania badań bezpieczeństwa przez amerykańską agencję federalną Bezpieczeństwa i Zdrowia w Pracy (OSHA), która zatwierdza krajową listę tego typu podmiotów.
Jedną z komórek organizacyjnych UL jest Firefighter Safety Research Institute (Instytut Badań nad Bezpieczeństwem Strażaków). W ciągu kilku ostatnich lat UL FSRI wygrał szereg konkursów na granty federalne przyznawane na badania nad środowiskiem pożaru oraz metodami prowadzenia działań przez strażaków. Obszerne i kompleksowe raporty z tego typu badań są powszechnie dostępne i stanowią podstawę rozwoju i doskonalenia taktyki działań gaśniczych ogromnej i wciąż rosnącej liczby straży pożarnych na całym świecie. Więcej informacji można znaleźć na stronie www.ulfirefightersafety.com
W oparciu o badania dokonane w UL FSRI stworzono współczesną krzywą pożaru, odzwierciedlającą obecne odkrycia badawcze. Poniżej można zobaczyć zestawienie tych dwóch krzywych – nazwanych umownie tradycyjną i współczesną.
.jpg)
Rys. 3: Współczesna krzywa pożaru wewnętrznego ukazująca etap pożaru kontrolowanego przez paliwo (KPP) i przez wentylację (KPW).
We współczesnej krzywej pożaru można wskazać kilka momentów, w których wymiana gazowa odgrywa ważną rolę. Po pierwsze każdy współczesny pożar przebiegający w pomieszczeniach z ograniczonym dopływem świeżego powietrza osiągnie moment, w którym nastąpi jego stłumienie z powodu niedoboru tlenu. Po drugie każde dopuszczenie tlenu – czy to wypadnięcie szyby czy otwarcie drzwi przez strażaków – spowoduje ponowną intensyfikację procesu spalania. Można na tym etapie wskazać kilka prawidłowości: im większy otwór tym szybszy i silniejszy efekt (i odwrotnie), im krótsza droga od otworu do ogniska pożaru tym szybsza reakcja (i odwrotnie), im wyżej usytuowany otwór tym łatwiejszy odpływ gazów pożarowych a trudniejszy dopływ tlenu (i odwrotnie) aczkolwiek zależy to oczywiście od wysokości usytuowania płaszczyzny neutralnej. Na krzywej widać też moment wycięcia otworu w dachu, powodującego kolejny rozwój pożaru. Można też dodać, że ograniczenie dopływu tlenu na każdym etapie pożaru kontrolowanego przez wentylację spowoduje spadek intensywności procesu spalania – zmniejszenie ilości wydzielającego się ciepła. Podobny efekt, na każdym etapie tego pożaru, przyniesie podanie wody na palące się materiały palne. Mówiąc ogólnie i z lekkim przymrużeniem oka, nic tak dobrze nie robi na pożar, jak woda ;)
Spójrzmy teraz na kolejny element „trójkąta”, wymieniany już kilkukrotnie w niniejszym tekście. Ciepło jest energią, która podczas spalania (i w pożarze) jest wytwarzana i rozchodzi się różnymi drogami. W fizyce energia jest definiowana, jako zdolność do wykonania pracy i definiowana jest w dżulach [J]. Wcześniej w tekście opisano parametr, jakim jest ciepło spalania. Ta wielkość charakterystyczna pokazuje potencjalną ilość energii możliwej do wydzielenia podczas spalenia jednostki masy danego paliwa. Wiadomo też, że o tej ilości ostatecznie zdecyduje dostępność tlenu potrzebnego do reakcji spalania. Często spotykanym w literaturze parametrem opisującym pomieszczenia pod względem pożarowym jest gęstość obciążenia ogniowego. Definiowana jest, jako energia cieplna, wyrażona w megadżulach, która może powstać przy spaleniu materiałów palnych znajdujących się w pomieszczeniu, strefie pożarowej lub składowisku materiałów stałych przypadająca na jednostkę powierzchni tego obiektu, wyrażona w metrach kwadratowych. [MJ/m2]. Z powyższych rozważań wynika jednak, że ów parametr ma znaczenie pośrednie, bowiem mówi o potencjalnej energii zawartej w paliwach, możliwej do uwolnienia po spaleniu całej masy – co w praktyce w pożarach jest rzadko spotykane. Niemniej przy dobrym dostępie powietrza, w pomieszczeniach o wyższej gęstości obciążenia ogniowego pożary będą przebiegać intensywniej! Dodatkowo, z większej ilości paliwa powstanie więcej gazów pożarowych w drodze rozkładu termicznego (pirolizy), a zatem warstwa zadymienia będzie zazwyczaj bogatsza w paliwo w formie gazowej.
Skoro pożar jest zjawiskiem dynamicznym, przechodzącym kolejne fazy rozwoju i przebiegającym w czasie, również wydzielane ciepło powinno być wyrażane w funkcji czasu. Ciepło wydzielane w danym czasie (przykładowo w jednostce czasu, jaką jest sekunda) jest mocą. Podobnie w pożarze, dana ilość ciepła w czasie [J/s] jest rozumiana, jako moc tego pożaru [W]. Inaczej nazywa się szybkością wydzielania się ciepła. Transport ciepła w pożarach następuje na trzech drogach:
- przewodzenie – przenikanie ciepła przez ciała stałe poprzez drgania cząsteczek. Niektóre ciała stałe przewodzą ciepło lepiej, inne gorzej. O tej zdolności mówi nam parametr, jakim jest przewodność termalna, wspomniana juz wcześniej przy omawianiu różnego rodzaju paliw. Jako przykład można podać pieczenie kiełbaski nad ogniskiem – drewniany patyk nie poparzy nas w ręce niezależnie od czasu pieczenia, natomiast metalowy pręt już po krótkim nagrzewaniu stanie się gorący na trzymanym końcu. Przewodnictwu cieplnemu ciał stałych towarzyszy jeszcze zjawisko rozszerzalności. Istnieje rozszerzalność objętościowa – zwiększanie wymiarów we wszystkich kierunkach, oraz rozszerzalność liniowa – charakteryzująca elementy o podłużnym kształcie. Niektóre materiały charakteryzują się wysoką wartością rozszerzalności cieplnej, towarzysząca zazwyczaj wysokiemu przewodnictwu. Przykładowo konstrukcje stalowe wykonane z podłużnych elementów o dobrym przewodnictwie i względnie wysokiej rozszerzalności liniowej w pożarach narażone są na szybkie poddanie się i awarie lub katastrofę budowlaną, bowiem elementy rozszerzają się wzdłuż, wyginają, skręcają, ścinają połączenia itp. W pożarach przewodzenie nie odgrywa znaczącej roli dla mechanizmu rozwoju i rozprzestrzeniania, natomiast odpowiada za odbieranie ciepła z pożaru przez materiały konstrukcyjne a po ugaszeniu pożaru – za oddawanie ciepła. Część ciepła oddawana jest do atmosfery w przypadku materiałów mających dobre przewodnictwo, jednak w budynkach występuje zazwyczaj więcej warstw, w tym warstwy termoizolacyjne mające zatrzymywać ciepło w budynku. Gromadzenie się ciepła w materiałach konstrukcyjnych oznacza też możliwość ich niszczenia! Podanie wody na rozgrzane materiały może spowodować szok termiczny i jeszcze szybsze niszczenie materiału.
- konwekcja – jest to transport ciepła wraz z masą, zachodzący w cieczach i gazach (w fizyce ciecze i gazy traktowane są jak płyny o różnych gęstościach z uwagi na zbliżoną mechanikę zachowania). Zazwyczaj wynika on z różnicy gęstości powodowanej różnicą temperatur. Istnieje też wymuszony transfer ciepła z masą, powodowany czynnikiem zewnętrznym. Transport ciepła w drodze konwekcji zależy od właściwości danego płynu: przewodnictwa cieplnego, gęstości oraz lepkości. Wpływ na niego ma też przepływ (jego prędkość i charakter) a także geometria powierzchni, na którą oddziałuje (rozmiary oraz kąt nachylenia względem przepływu). Opływając daną powierzchnię, ciepło z przepływającej masy przekazywane jest tej powierzchni. Może to być powierzchnia palna kanapy, ściana działowa czy też ubranie na człowieku. Im szybszy przepływ tym większa ilość przekazywanego ciepła. Dlatego łatwiej jest wysuszyć mokre włosy suszarką, aniżeli siedząc w pomieszczeniu z podgrzanym powietrzem. A skoro ciepło wędruje zazwyczaj od obszaru o wyższej temperaturze do obszaru o niższej, to również dlatego ręka wystawiona za okno podczas jazdy samochodem zmarznie tym bardziej, im szybciej jedzie ów samochód (temperatura powietrza niemal zawsze jest niższa niż temperatura ciała)! W pożarach bardzo duża ilość ciepła wydzielanego podczas spalania transportowana jest na drodze konwekcji: tworzy się tzw. kolumna konwekcyjna ognia (KKO), czyli przestrzeń istniejąca wokół płomienia i w nim, w której zachodzi transport ciepła spowodowany zmianą gęstości płynu (w naszym przypadku chodzi o gazowe produkty spalania oraz powietrze zasysane do KKO) wynikającą ze zmian temperatury. Z uwagi na mniejszą gęstość względem powietrza (i powstającą tzw. wyporność tj. tendencję do przepływu w kierunku przeciwnym do przyciągania ziemskiego), gorące gazy pożarowe będą gromadziły się w górnych częściach pomieszczeń i w miarę możliwości wędrowały ku górze (np. po wydostaniu się na klatkę schodową). Jeśli nie mają możliwości wędrówki ku górze, wówczas będą się rozpływać na boki. Stąd różne efekty towarzyszące rozprzestrzenianiu się zadymienia. O efekcie kominowym mówimy wówczas, gdy wędrujące w górę gorące gazy (a zatem ogrzana masa) tworzą pęd (będący iloczynem masy i prędkości), czyli potocznie mówiąc wytwarzają tzw. cug. Wówczas dochodzi do zasysania mas gazów (zazwyczaj powietrza) znajdujących się w bezpośrednim sąsiedztwie opisywanego przepływu. Zasysanie zwiększa masę przepływającego płynu i może obniżać jego temperaturę (a zatem zmniejszać prędkość), jeśli zasysany płyn (w naszym przypadku powietrze) ma niższą temperaturę. Innym efektem, towarzyszącym pożarom w obiektach, jest tzw. „efekt grzyba” czyli rozchodzenie się dymu na boki po osiągnięciu najwyższego punktu, do którego dym może się rozprzestrzenić. Kształt obszaru zadymionego przypomina grzyb – z wąskim pionowym trzonem i szerokim poziomym kapeluszem. Efekt ten jest zauważalny, gdy dym wydobywa się z mieszkania usytuowanego nisko w bloku na klatkę schodową – najpierw dym wędruje głównie ku górze po klatce schodowej, a po ociągnięciu ostatniego piętra zaczyna rozpływać się na boki i wypełniać korytarze.
- promieniowanie – jest to transport energii cieplnej na drodze fal elektromagnetycznych. Odmiennie od przewodzenia i konwekcji nie wymaga ośrodka (środowiska), w którym zachodzi transport ciepła (przykładowo promienie słoneczne wędrują na Ziemię przez próżnię w przestrzeni kosmicznej). W jednolitym środowisku promieniowanie rozchodzi się równomiernie we wszystkich kierunkach – promieniście, tj. pokrywając się z promieniem wyimaginowanej kuli, w centrum której znajduje się źródło promieniowania. Ów sposób transportu ciepła staje się dominującym w pożarach, kiedy średnica ogniska pożaru wzrasta ponad około 0,3 m. Promieniowanie odpowiada wtedy za szybkość rozwoju i rozprzestrzeniania się pożaru w pomieszczeniach. Poprzez mechanizm promieniowania, obiekty oddalone od ogniska pożaru mogą ulegać nagrzaniu do temperatury samozapłonu. W pożarach zewnętrznych promieniowanie odpowiada za rozprzestrzenianie się pożarów np. w lasach czy między budynkami. Powstająca w płomieniu znaczna ilość ciepła przekazywana jest w drodze promieniowania do otoczenia. Większa część tego promieniowania emitowana jest przez maleńkie cząstki stałe sadzy, powstające niemal zawsze przy spalaniu dyfuzyjnym (tzn. takim, gdzie paliwo i utleniacz nie są wstępnie wymieszane i musi dojść do ich wymieszania – dyfuzji – zanim osiągnięte zostaną stężenia paliwa i tlenu zdolne wytworzyć czy podtrzymać zjawisko spalania). Spalaniu cząstek sadzy towarzyszy charakterystyczne żółtawe światło. Jak już sugerowano wcześniej, każdy materiał charakteryzuje się pewnym ciepłem spalania jak również pojemnością cieplną – obie cechy charakterystyczne można powiązać ze zjawiskiem promieniowania. Ciepło spalania wskazuje na ilość energii, która wydzieli się podczas pożaru i będzie transportowana do otoczenia na 3 wymienione sposoby (przewodzenie, konwekcja i promieniowanie). Pojemność cieplna wskaże, ile ciepła (głównie w drodze promieniowania) przyjmie dany materiał, zanim jego temperatura wzrośnie o daną wartość. Promieniowanie cieplne rozchodzi się poprzez tzw. strumień ciepła. Definiowany jest on, jako prędkość przepływu ciepła, będąca stosunkiem danej ilości ciepła do jednostki czasu [J/s] lub [W], jest więc formą transportu ciepła w drodze promieniowania. W literaturze spotyka się również pojęcia “szybkość wydzielania się ciepła” lub “moc pożaru” na określenie tej dynamiki towarzyszącej emisji ciepła. Można w uproszczeniu powiedzieć, że ilość promieniowania cieplnego powiązana jest z wielkością płomienia – im większy płomień, tym większe promieniowanie. Aby lepiej rozumieć i obrazować dynamikę tej formy transportu ciepła, wprowadzono parametr zwany gęstością strumienia ciepła. Jest to strumień ciepła padający na daną powierzchnię, inaczej nazwany gęstością promieniowania cieplnego [W/m2].
W tym miejscu wypada zaznaczyć, że fizyka definiuje jedynie pojęcie ciepła. Zimno jest w fizyce niemierzalne – istnieje jedynie ciepło lub jego brak. Stąd w fizyce mówi się o skali temperatur mierzonej w Kelwinach (istnieją Kelwiny lub stopnie Celsjusza), która to skala nie posiada wartości ujemnych. Tzw. zero absolutne, czyli niejako początek skali temperatur mierzonej w Kelwinach, to temperatura 0 [K] lub -273,15 [°C]. Ponownie trzeba podkreślić – mówimy albo o Kelwinach (nie o stopniach Kelwina!) albo o stopniach Celsjusza (nie o Celsjuszach). Podobnie ciężko w fizyce mówić o ciemności – która jest brakiem światła. Dlatego z pewną dozą dystansu należy traktować doniesienia pogodynki, mówiące o 15 stopniach mrozu!
Jaka jest zatem różnica między ciepłem a temperaturą? Jako pierwszy przykład rozpatrzmy wodę. Wiadro wody napełnione do poziomu 10 litrów porównajmy ze szklanką wody napełnioną do poziomu 250 mililitrów. Załóżmy pewne uproszenie tzn. przyjmijmy, że woda w każdym z naczyń ogrzana jest równomiernie i ma jednolitą temperaturę w całej swojej objętości. Jeśli woda w wiadrze ma temperaturę 50°C a woda w szklance 100°C to potocznie powiemy, że w szklance woda jest cieplejsza. Poprawnie należałoby stwierdzić, że ma ona wyższą temperaturę! Woda w szklance wchłonęła 2 razy więcej ciepła do każdej cząsteczki, w celu osiągnięcia swojej temperatury, aniżeli woda w wiadrze. Natomiast w wiadrze znajduje się 40 razy więcej wody niż w szklance, a więc ilość ciepła dostarczona w celu ogrzania całej ilości wody w wiadrze do 50°C musiała być 20 razy większa niż ta dostarczona do szklanki. Jak widać ilość danej substancji ma wpływ na to, jak ciepło wpływa na jego temperaturę. Jeśli porównać taką samą ilość dwóch różnych substancji – przykładowo wody oraz rtęci – można zauważyć kolejną zależność. Wartość ciepła właściwego wody wynosi 4186 (J/kgK) a rtęci 140 (J/kg·K). Widzimy zatem, że wartość dla wody jest w przybliżeniu 30 razy większa – a zatem dla ogrzania tej samej ilości wody potrzeba blisko 30 razy więcej energii cieplnej aniżeli do ogrzania rtęci. Dostarczając taką samą ilość ciepła do obu cieczy (zakładając brak strat ciepła do otoczenia) rtęć podgrzejemy do znacznie wyższej temperatury!
.jpg)
Rys. 4: Różnica między ciepłem a temperaturą.
Ciepło gromadzące się w substancjach przekłada się zatem na osiąganą przez nie temperaturę, a sam ten proces zależy od właściwości danej substancji lub mieszaniny substancji, jak też od ich stanu skupienia. Ciecze i gazy mają zdolność mieszania się i ich nagrzewanie może przebiegać w miarę równomiernie w całej objętości, podczas gdy w ciałach stałych rozchodzenie się ciepła ma miejsce jedynie na drodze przekazywania ciepła między sąsiadującymi cząsteczkami. Dlatego w ciałach stałych miejsce wystawione na oddziaływanie ciepła ogrzeje się jako pierwsze a potem ciepło rozejdzie się na dalsze obszary tego ciała – zależnie od jego przewodnictwa. Drewniany patyk prędzej zacznie się palić, niż całkowicie się ogrzeje, podczas gdy metalowy pręt nagrzeje się cały, ale raczej nie zapali. Oczywiście istnieją ciała, które po podgrzaniu zmieniają stan skupienia na ciekły (topią się) a następnie parują – każda substancja ma właściwą sobie temperaturę topnienia (na tym samym poziomie jest temperatura krzepnięcia – procesu odwrotnego) oraz parowania (i procesu odwrotnego – skraplania). Przykładowo dla wody są to odpowiednio 0°C (ok. 273,15 K) i 100°C (ok. 373,15 K). Jednak woda jest substancją niepalną, a wiele substancji zachowujących się podobnie (topiące i odparowujące) jest palnych – przykładowo szereg tworzyw sztucznych. Inne substancje (drewno, niektóre tworzywa sztuczne, gumy) zwęglają się i nie przechodząc przez ciekły stan skupienia. Zależnie od zachowania w pożarze, substancje są ogólnie klasyfikowane do różnych „grup pożarów”. Niezależnie od tego, z punktu widzenia procesu spalania i pożaru, każda podgrzewana substancja zanim ulegnie spalaniu płomieniowemu musi przejść w stan skupienia gazowy. Płomień jest bardzo rozgrzaną przestrzenią gazową, w której miesza się (lub jest wstępnie wymieszane) paliwo gazowe z powietrzem (w tym z tlenem).
Ciała stałe, które nie podlegają topnieniu, przechodzą w pożarach etap tzw. pirolizy. Piroliza, czyli rozkład termiczny, to nieodwracalny rozkład chemiczny danej substancji pod wpływem oddziaływania ciepła. Osiągnięcie pewnej temperatury (różnej dla poszczególnych substancji, ale na ogół zawierającej się w przedziale 150-250°C), powoduje niszczenie wiązań pomiędzy cząsteczkami i ulatnianie się paliwa w formie gazowej. Jest to paliwo, które posiada dużą potencjalną energię, ponieważ nie uległo jeszcze spaleniu. Wzbogacając warstwę zadymienia może prowadzić do spalania się dymu i gazów pożarowych z wydzielaniem dużych ilości ciepła. „Dym z pirolizy”, czyli produkty rozkładu termicznego, ma najczęściej jasną barwę, bowiem względnie niska temperatura, nieznaczne prądy konwekcyjne i stosunkowo nienaruszona struktura ciała stałego ulegającego rozkładowi termicznemu powodują, że do produktów gazowych przedostaje się niewielka ilość sadzy, barwiącej dym na ciemny kolor.
Dla większości substancji można też wyznaczyć parametr temperatury samozapłonu. W momencie nagromadzenia pewnej wystarczającej ilości ciepła dana substancja zaczyna automatycznie się spalać – możliwe jest to bez udziału płomienia zapalającego czy iskry. Energia zapłonu została osiągnięta i substancja spala się. Dotyczy to zarówno ciał stałych jak i gazów (większość cieczy palnych w tej temperaturze występuje jako gaz z uwagi na przekroczoną temperaturę parowania). Tu ponownie wartości są różne dla poszczególnych substancji czy ich mieszanin, ale można umownie wskazać przedział 500-600°C dla samozapłonu gazów pożarowych (w tym około 600°C dla tlenku węgla – CO), 300-470°C dla różnych gatunków drewna, 220-470°C dla cieczy palnych, około 230°C dla papieru, 350-570°C dla większości tworzyw sztucznych.
Ostatnim elementem omawianego czworokąta spalania są wolne rodniki. Jak wspomniano wcześniej, spalanie jest reakcją zachodzącą pomiędzy paliwem a utleniaczem. W wyniku tej reakcji dochodzi do niszczenia struktury spalającego się materiału na poziomie molekularnym. Ten nieodwracalny proces rozkładu termicznego i spalania to reakcja chemiczna, w której paliwo, utleniacz oraz inne obecne związki (azot i inne gazy z powietrza, składniki dymu itd.) przechodzą szereg reakcji składowych, w wyniku których powstają nowe związki chemiczne. O ile w spalaniu zupełnym mamy do czynienia trwałymi produktami (CO2, H2O i inne związki) to w warunkach pożaru owe produkty będą inne, jak również będzie możliwe ich uleganie dalszemu spalaniu (wchodzenie w dalsze reakcje) i tworzenie innych produktów. Przytoczony został wcześniej przykład spalania metanu, który osiąga końcowe produkty przechodząc przez 123 reakcje pośrednie. W trakcie tego procesu, przebiegającego bardzo szybko, dochodzi do łączenia i rozłączania się kolejnych cząsteczek. Każdy pierwiastek charakteryzuje się tzw. „wartościowością” czyli cechą, mówiąca o tym, iloma wiązaniami chemicznymi dany pierwiastek może łączyć się z innymi. Niektóre pierwiastki mają jedną stałą liczbę określającą wartościowość, inne mogą mieć różne liczby wartościowości, zależnie od pierwiastka, z którym tworzą związek. Jeśli przyjrzymy się cząsteczce wody (H-O-H) to widzimy, że każda atom wodoru (H) ma jedno wiązanie, natomiast atom tlenu (O) ma dwa wiązania. Jeśli jeden atom wodoru zostanie zabrany, wówczas powstaje związek chemiczny (H-O-), w którym atom tlenu ma jedno wolne wiązanie. Oznacza to, że powstał wolny rodnik – połączenie szukające pary. W ten sposób na poziomie chemicznym rozpoczyna się łańcuchowa, rozgałęziona reakcja, dzięki której rozkład substancji i wiązanie się atomów i związków w inne związki jest możliwe dzięki tym wolnym, niesparowanym wiązaniom międzyatomowym. Zatem wolne rodniki to powstające przy reakcji chemicznej nieodwracalnego rozkładu i utleniania związki chemiczne lub pierwiastki, mające wolne wiązanie i mogące wchodzić w dalsze reakcje chemiczne z innymi substancjami lub pierwiastkami. Warunkują one łańcuchowy i rozgałęziony przebieg reakcji spalania. W mechanizmie spalania fazy gazowej najaktywniejszymi wolnymi rodnikami są -H, -OH oraz –CH3. Do występowania wolnych rodników wymagana jest wysoka temperatura, stąd jej obniżenie powoduje nagłą likwidację płomienia (następuje to skokowo a nie w sposób stopniowy).
Dlaczego pojawiły się wolne rodniki? Ponieważ naukowcy odkryli, że w procesie spalania duże znaczenie ma rozgałęziona reakcja łańcuchowa. W ślad za ty powstały środki gaśnicze, mające zdolność „wyłapywania” wolnych rodników i wiązania się z nimi, zanim wejdą w reakcję z kolejnymi cząsteczkami. Dzięki temu proces spalania jest zakłócany, bowiem nie ma cząsteczek i związków chemicznych jak też energii niezbędnej do samoczynnego podtrzymania procesu spalania. Poprzez wyeliminowanie tego elementu procesu spalania osiąga się przerwanie całego procesu. Gaszenie polega bowiem na odebraniu jednego lub kilku elementów czworokąta. Środkami gaśniczymi wpływającymi na zabranie tego elementu czworokąta są halony (gazy gaśnicze, wycofane z uwagi na szkodliwość dla warstwy ozonowej atmosfery), zamienniki halonów (inne gazy gaśnicze, wprowadzone zamiast halonów) oraz proszki gaśnicze.
Literatura:
[1] PN-B-02852 Ochrona przeciwpożarowa budynków. Obliczanie gęstości obciążenia ogniowego oraz wyznaczanie względnego czasu trwania pożaru;
[2] Bengtsson L.-G., Enclosure fires, Swedish Rescue Services Agency, 2001;
[3] Kordylewski, W., (red), Spalanie i paliwa, Oficyna Wydawnicza Politechniki Wrocławskiej, Wrocław 2008;
[4] Estimation of Rate of Heat Release by Means of Oxygen Consumption Measurements, http://nvlpubs.nist.gov/nistpubs/sp958-lide/280-282.pdf;
[5] Study of the Effectiveness of Fire Service Vertical Ventilation and Suppression Tactics in Single Family Homes, Steve Kerber, 2013, http://ulfirefightersafety.com/wp-content/uploads/2013/07/UL-FSRI-2010-DHS-Report_Comp.pdf;
[6] Mizieliński, B., Kubicki, G., Wentylacja pożarowa. Oddymianie, WNT Warszawa, 2012;
[7] Flammability Handbook for Plastics, Hilado, Carlos J., Published by Lancaster, Pennsylvania, U.S.A.: Technomic Pub Co, 1998;
[8] An introduction to fire dynamics. Second edition, D. Drysdale, John Wiley & Sons, England, 1999;
[9] Särdqvist, S., Water and other extinguishing agents, Swedish Rescue Services Agency, 2002;
